
Contenu
- TL; DR (Trop long; n'a pas lu)
- Comment calculer les taupes
- Conversion en Mmol
- Concentration de la solution
- Exemple
Pour simplifier leurs calculs, les chimistes ont créé une unité standard pour le nombre d'atomes d'un composé particulier impliqué dans une réaction ou un autre processus chimique. Ils définissent une mole (mol) comme la quantité de toute substance ayant le même nombre d'unités fondamentales que 12 grammes de carbone 12, ce qui correspond à un nombre d'Avogadros (6,022 × 10).23). Le système de mesure SI (métrique) définit une millimole (Mmol) en millième de mole. Vous calculez généralement le nombre de moles d'une substance en pesant la quantité que vous avez sous la main. Si vous voulez convertir en Mmol, multipliez par 103 (1,000).
TL; DR (Trop long; n'a pas lu)
Une mole est égale au nombre d'Avogadros de particules d'un composé particulier. Une millimole (Mmol) est un millième de mole.
Comment calculer les taupes
Les masses atomiques sont mesurées en unités de masse atomique (AMU). Une UMA représente exactement 1/12 de la masse du noyau d'un atome de carbone 12 dans son état fondamental. Une mole de substance est définie comme étant égale au nombre d'Avogadros de particules de cette substance. Selon cette définition, le poids d'une mole d'une substance en grammes est le même nombre que le poids d'une particule individuelle de cette substance dans l'UMA. Par exemple, le poids atomique du carbone 12 est de 12 AMU. Une mole de carbone 12 pèse donc 12 grammes.
Considérez un récipient plein d’hydrogène (H2). Chaque particule dans le conteneur est une molécule composée de deux atomes d'hydrogène. Il vous suffit donc de connaître la masse atomique d'hydrogène pour calculer le poids moléculaire. La plupart des versions du tableau périodique répertorient la masse atomique de chaque élément sous son symbole. Pour l'hydrogène, qui a un seul proton dans son noyau, son 1.008 AMU, qui est une moyenne de tous les isotopes naturels de l'hydrogène. En conséquence, la masse atomique d'hydrogène gazeux est de 2,016 AMU et une mole d'hydrogène gazeux pèse 2,016 grammes. Pour trouver le nombre de moles dans votre échantillon, pesez l’échantillon en grammes et divisez ce poids par le poids moléculaire de l’hydrogène gazeux en grammes. Par exemple, un échantillon pesant 15 grammes d’hydrogène pur contient 7,44 moles.
Conversion en Mmol
Parfois, les quantités à l’étude sont si petites qu’il est difficile de les exprimer en taupes. Entrez la millimole. En multipliant le nombre de moles par mille, vous pouvez convertir un très petit nombre en un nombre plus facile à gérer. Ceci est particulièrement pratique lorsque vous utilisez des unités de volume de l'ordre du millilitre.
1 mol = 1000 Mmol
Concentration de la solution
Les chimistes utilisent la molarité comme mesure de la concentration d'un composé particulier en solution. Ils définissent la molarité comme le nombre de moles par litre. Vous convertissez la molarité en millimolarité en multipliant par 1 000. Par exemple, une solution de 1 mol (molaire, également écrite en M) a une concentration de 1 mole par litre. Cela équivaut à une solution de 1 000 mmol (millimolaire, parfois écrite également en mM), qui contient 1 000 mmol par litre.
Exemple
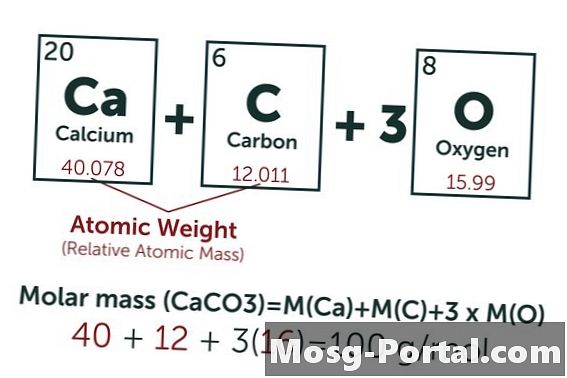
Une solution contient 0,15 gramme de carbonate de calcium. Combien de millimoles est-ce?
La formule chimique du carbonate de calcium est CaCO3. La masse atomique du carbone (C) est d’environ 12 AMU, celle de l’oxygène (O) à environ 16 AMU et celle du calcium (Ca) à environ 40 AMU. Chaque molécule de carbonate de calcium pèse donc 100 UMA, ce qui signifie qu’une mole pèse environ 100 grammes. Un poids de 0,15 gramme représente 0,15 g ÷ 100 g / mol = 0,0015 mole. Ceci équivaut à 1,5 Mmol.
Quelle est la molarité et la millimolarité de cette quantité de carbonate de calcium dans 2,5 litres de solution?
La molarité est définie comme le nombre de moles par litre; divisez donc le nombre de moles par 2,5 pour obtenir la molarité: 0,0015 2,5 =
0,0006 M
Multipliez par 1 000 pour obtenir la millimolarité =
0,6 mM
Notez que vous obtenez le même résultat pour la millimolarité si vous divisez le nombre de millimoles par le volume de la solution.