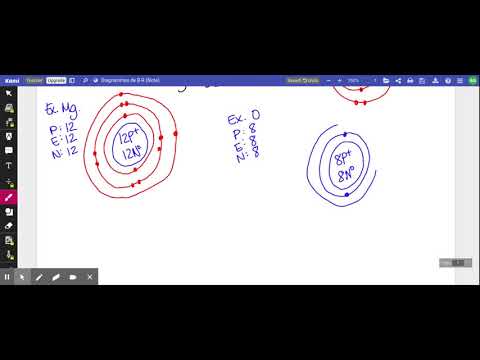
Un diagramme de Bohr est une représentation visuelle simplifiée d'un atome qui a été développée par le physicien danois Niels Bohr en 1913. Le diagramme représente l'atome comme un noyau chargé positivement entouré d'électrons qui voyagent en orbite circulaire autour du noyau à des niveaux d'énergie discrets. Les diagrammes de Bohr sont utilisés pour initier les étudiants à la mécanique quantique en raison de leur simplicité et constituent un bon moyen de montrer aux étudiants comment les électrons sont organisés en niveaux d'énergie discrets.
Consultez le tableau périodique des éléments pour connaître le type d'atome que vous allez représenter dans un diagramme de Bohr. Notez son numéro atomique et son numéro de masse. Le numéro atomique est le nombre de protons et le nombre de masse est le nombre de protons et de neutrons. Le nombre d'électrons est égal au nombre de protons. Voir la ligne du tableau périodique dans laquelle se trouve votre élément. Les éléments de la première ligne (hydrogène et hélium) ont un niveau d'énergie, ceux de la deuxième ligne auront deux niveaux d'énergie, etc.
Tracez un cercle pour représenter le noyau de l'atome. Écrivez le symbole de l'élément, le nombre de protons et le nombre de neutrons à l'intérieur de ce cercle. Tracez un ou plusieurs cercles autour du noyau en fonction de la rangée du tableau périodique de votre élément. Chaque anneau représente un niveau d'énergie différent pour les électrons.
Dessinez des électrons sous forme de points sur les anneaux représentant les niveaux d'énergie. Chaque anneau a un nombre maximum d'électrons qu'il peut contenir. Le premier anneau (interne) ne peut contenir que deux électrons, le deuxième niveau peut en contenir huit, le troisième peut en contenir 18 et le quatrième 32. Ce diagramme est maintenant un diagramme de Bohr.