Les atomes consistent en un noyau dense, ou noyau, qui contient des particules chargées positivement appelées protons et des particules non chargées appelées neutrons. Les électrons chargés négativement occupent des régions d'espace confinées à l'extérieur du noyau, appelées orbitales. Les protons et les neutrons pèsent presque 2 000 fois plus que les électrons et représentent donc la quasi-totalité de la masse d'un atome. Pour tout élément du tableau périodique, le nombre de protons dans les noyaux de ses atomes est cohérent. Chaque atome de carbone, par exemple, contient six électrons. Le nombre d'électrons correspond au nombre de protons dans un atome neutre, mais les atomes peuvent gagner ou perdre des électrons lors de réactions chimiques. Le nombre de neutrons varie également d'un atome à l'autre. Les chimistes font référence aux atomes du même élément avec des nombres différents de neutrons sous forme d'isotopes. Comprendre ces termes représente la clé pour déterminer les protons, les neutrons et les électrons dans un isotope.
Identifiez le nombre de masse de l'isotope à partir de son symbole. Par convention, les scientifiques définissent le numéro de masse d'un isotope sous la forme d'un nombre en exposant devant le symbole élémentaire, tel que 235U, ou avec un trait d'union après le symbole, comme dans U-235.
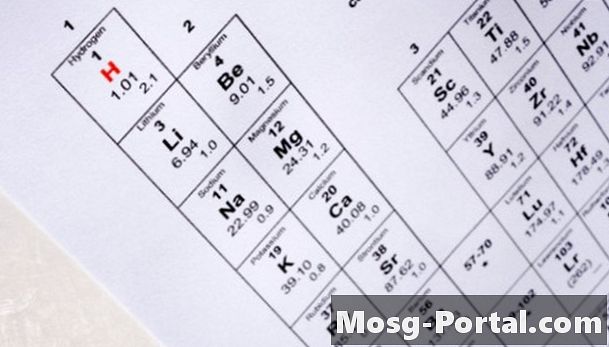
Déterminez le nombre de protons dans le noyau de l’isotope en localisant son numéro atomique dans le tableau périodique des éléments. Le tableau périodique organise les éléments en augmentant le numéro atomique. U, par exemple, représente le symbole chimique de l'uranium et possède un numéro atomique de 92. Cela signifie que tous les atomes d'uranium contiennent 92 protons dans leur noyau.
Calculez le nombre d'électrons contenus dans l'isotope en notant si son symbole comprend une charge. La notation de charge représente un nombre positif ou négatif, généralement écrit en exposant après le symbole chimique, tel que 235U (4+). Cela indique que l'atome d'uranium a perdu quatre électrons. En l'absence d'une charge déclarée, l'isotope possède une charge de zéro et son nombre d'électrons est égal à son nombre de protons. Soustrayez les charges positives de ou ajoutez des charges négatives au numéro atomique si le symbole contient une charge indiquée. Le 235U (4+), par exemple, contiendrait 92 - 4 = 88 électrons.
Trouvez le nombre de neutrons dans l'isotope en soustrayant le nombre de protons du nombre de masse indiqué dans le symbole. Par exemple, 235U, qui contient 92 protons, contient donc 235 - 92 = 143 neutrons.