Contenu
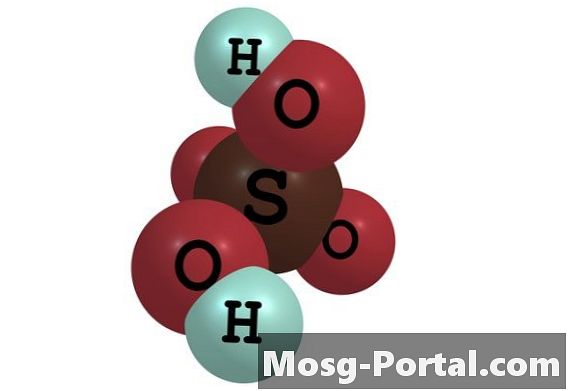
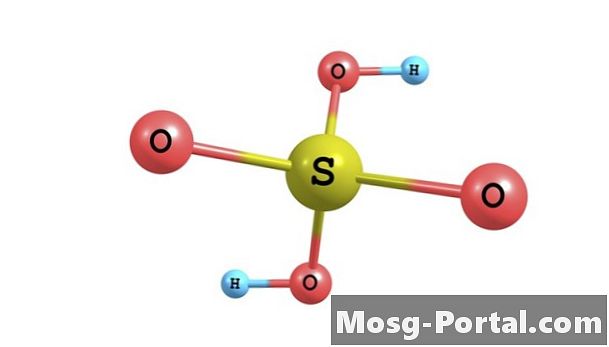
L'acide sulfurique est un acide inorganique fort couramment utilisé dans la production industrielle de produits chimiques, dans les travaux de recherche et en laboratoire. Il a la formule moléculaire H2SO4. Il est soluble dans l'eau à toutes les concentrations pour former une solution d'acide sulfurique. Dans la solution, une mole d'acide sulfurique se sépare en une mole d'ions sulfate chargés négativement, ou SO4 (2-), et de 2 moles d'ions hydronium chargés positivement, ou H3O +. La concentration de ces ions est exprimée en molarité, définie comme le nombre de moles d'ions par litre de solution. Leur concentration dépend de la concentration initiale en acide sulfurique.