Contenu
Le titrage est utilisé pour déterminer la concentration d'une substance inconnue via la relation molaire exprimée par l'équation de réaction chimique. En utilisant ces relations, la valeur du pH peut être déterminée en calculant la concentration en ions hydrogène (H +) et en appliquant l'équation du pH. En règle générale, la titration utilise un indicateur de pH dans la solution inconnue qui change de couleur lorsque la solution atteint un pH neutre (en fonction de l'indicateur, vous pouvez choisir le pH auquel le changement de couleur se produit). Compte tenu de ce que l'on sait sur la solution que vous avez ajoutée pour neutraliser l'inconnu, vous pouvez trouver le pH de la solution inconnue.
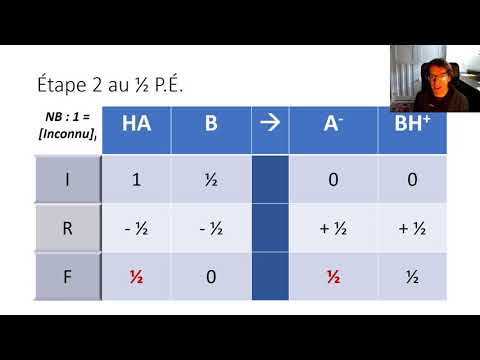
Prenez les résultats de votre expérience de titrage et calculez le nombre de moles (mol) de standard nécessaires pour réagir avec l'inconnu. Commencez par prendre le volume de standard que vous avez ajouté et convertissez-le en nombre de moles de la molécule standard. Vous devez connaître la concentration de l'étalon et le volume ajouté à l'inconnu. Ces deux pièces peuvent être combinées en multipliant le volume ajouté (en litres) et la concentration (en moles par litre). Maintenant, vous avez les moles de standard qu'il a fallu pour neutraliser la solution inconnue.
Reliez les moles de solution standard aux moles de solution inconnue. S'agissant d'une réaction de neutralisation, supposons que la solution standard soit la base (ions OH-). Vous avez calculé les moles de base nécessaires pour neutraliser l'acide inconnu (H +). Utilisez le nombre calculé de moles de base et reliez-le, par l’équation de la réaction chimique, au nombre de moles d’acide dans l’inconnu. Si votre réaction est de 1 mole de base pour 1 mole d’acide (comme le sont le plus souvent les cas), alors vous savez que le nombre de moles d’étalon est identique au nombre de moles d’inconnu. Si le nombre n'est pas compris entre 1 et 1, multipliez ensuite par le facteur correct (il s'agit d'une réaction spécifique). Vous avez maintenant le nombre de moles d'acide (H +) dans la solution inconnue.
Convertissez le nombre de moles de H + en concentration de H + en prenant le nombre de moles de H + et en le divisant par le volume (en litres) d’inconnu que vous aviez au départ. Cela vous donne la concentration de H + dans la solution inconnue.
Prenez la concentration de H + (en moles par litre) et insérez-la dans la formule de pH suivante: pH = -log (H +). Déterminez le log négatif de la concentration en H + à l'aide de votre calculatrice. Vous arriverez à la valeur de pH de la solution inconnue. Si votre solution est acide, votre pH sera inférieur à sept. si neutre, un pH égal à sept; et si basique, un pH supérieur à sept.