Contenu
- Définition
- Acide éthylènediaminetétracétique et méthode potentiométrique
- Titrage complexométrique
- Solution Burette
Les scientifiques s’appuient sur le titrage direct pour déterminer la quantité d’une substance dans une solution présentant des réactions chimiques. Lorsqu'il est exécuté correctement, ce processus permet de représenter très précisément les quantités de produits chimiques à l'aide d'acides spécialisés et de verrerie de laboratoire. Pour que le titrage fonctionne correctement, le dernier complexe doit se former suffisamment rapidement pour que les scientifiques puissent l’analyser.
Définition
Le titrage direct est un moyen de déterminer quantitativement le contenu d'une substance. Les scientifiques peuvent être conscients de la présence d’un réactif, mais ne pas connaître la quantité de réactif. Le titrage direct est parfois basé sur des indicateurs qui répondent au matériau analysé, appelé analyte. D'autres fois, les méthodes sont basées sur l'utilisation d'ions métalliques ajoutés, qui sont des atomes individuels ou des molécules d'un type spécifique de métal.
Acide éthylènediaminetétracétique et méthode potentiométrique
Les techniciens peuvent effectuer un titrage avec de l'acide éthylènediaminetétracétique avec des indicateurs à ions métalliques. Cette méthode ne fonctionne pas dans toutes les situations, car la réaction est parfois si lente que le titrage devient irréaliste. L'ion métallique utilisé doit avoir une stabilité moindre que l'analyte. Une autre méthode de titrage direct est la méthode potentiométrique, utilisée pour la détection de points finaux avec des ions métalliques ayant des électrodes spécifiques disponibles. Le point final est le point où le processus de titrage se termine.
Titrage complexométrique
Pour le titrage complexométrique, les scientifiques utilisent des acides aminopolycarboxyliques pour identifier les métaux. Des complexes colorés se forment et les scientifiques utilisent les données recueillies à partir de cette formation pour déterminer la quantité d'analyte. La méthode directe de titrage complexométrique implique l’utilisation d’une solution de sel métallique titrée avec une solution de composé complexant. Les solutions de composés complexants contiennent des atomes ou des composés qui forment des complexes avec d'autres atomes ou composés. Les scientifiques trouvent le point d'équivalence à partir d'un indicateur ajouté. Le point d'équivalence correspond au moment où le réactif ajouté est stoechiométriquement égal à l'analyte. La stœchiométrie implique un équilibrage des réactions chimiques.
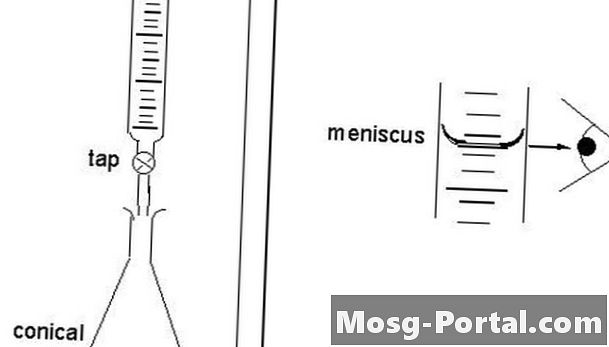
Solution Burette
Le titrage direct est appelé "direct" car le scientifique approche directement du point final. Le titrant pénètre dans la solution par les gouttes de la burette pour que la dernière goutte ne dépasse pas le point final. Grâce à la titration directe, les scientifiques traitent une substance soluble contenue dans une solution, qui est contenue dans un récipient appelé titrer. La solution standardisée s'appelle le titrant. Le point final est déterminé de manière instrumentale ou visuelle à l’aide d’un indicateur. Les scientifiques ajoutent le réactif à la burette appropriée, une pièce de verrerie verticale et cylindrique avec un robinet de précision qui libère de petites quantités de liquide en quantités spécifiques. Les scientifiques remplissent la burette à une capacité de 30 à 100%.