Contenu
En chimie, les électrons de valence sont souvent au centre des études car ils jouent un rôle essentiel dans le comportement de liaison d'un atome. Le Dr Nivaldo Tro définit les électrons de valence comme ceux qui existent dans la couche énergétique la plus externe d'un atome. Identifier rapidement le nombre d'électrons de valence est important dans la maîtrise de la chimie. Selon l'Université du Colorado à Boulder, les valences sont utilisées pour déterminer la place des éléments dans le tableau périodique périodique d'éléments. Le Clackamas Community College souligne que les principaux éléments couramment utilisés dans les réactions chimiques, tels que le carbone et l'oxygène, présentent des comportements uniques en raison du nombre d'électrons de valence qu'ils possèdent. La méthode la plus simple pour déterminer les valences consiste simplement à consulter le tableau périodique.
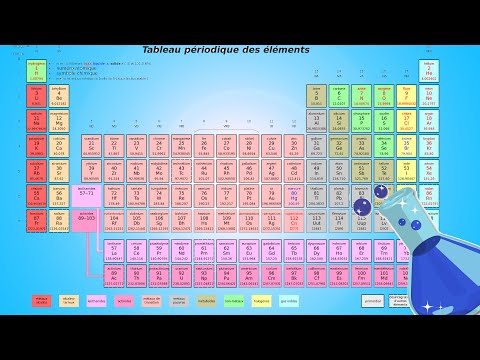
Placez une copie des éléments du tableau périodique sur une surface où tous les atomes représentés sur le tableau sont facilement atteints. Il peut souvent être utile de pointer physiquement chaque rangée au fur et à mesure que vous l'examinez afin de développer une impression instinctive de la disposition du graphique.
Regardez la colonne la plus à gauche du tableau périodique. C'est le début de la table et l'élément le plus important est l'hydrogène - l'élément constitutif de la matière tel que nous le comprenons. Cette colonne s’appelle "Groupe 1" et, à l’aide d’un stylo ou d’un crayon, vous devez étiqueter une fiche de correspondance avec le titre "Colonne 1." Le tableau périodique est organisé en fonction des valences et la première colonne d'éléments contient tous les éléments avec un électron de couche de valence. Ajoutez ce fait à votre notecard et incluez tous les autres périphériques permettant de vous en rappeler, ainsi que les noms des sept éléments répertoriés dans la colonne 1.
Examinez la colonne immédiatement à droite de la colonne 1. Etiquetez une carte de correspondance "Colonne 2" et notez que cette colonne contient les éléments du groupe 2 - la famille des éléments à deux électrons de valence. Les deux premières colonnes sont connues sous le nom de métaux et se trouvent couramment dans les sels et les composés ioniques. Il y a six éléments dans ce groupe et leurs noms doivent figurer sur votre notecard.
Étiquetez une carte de notes avec le titre "métaux de transition" et mettez-la de côté. Les 10 colonnes suivantes situées à droite du groupe 2 contiennent des électrons de valence, mais les règles qui s’appliquent ne suivent pas exactement la configuration de ces éléments dans le reste du tableau périodique. Il est plus facile de les regrouper en tant que métaux de transition et d’ignorer leurs numéros de groupe.
Trouvez le néon (Ne) à l'extrême droite du tableau périodique et comptez six points. Vous arriverez au bore (B) et les éléments sous-jacents du tableau périodique entrent dans la catégorie des éléments du groupe 3. A partir de là, les colonnes sont numérotées séquentiellement selon le même schéma que les colonnes 1 et 2. Ainsi, les éléments relevant du carbone (C) sont des éléments du groupe 4 avec 4 électrons de valence, ceux sous azote (N) sont des éléments du groupe 5 avec 5 électrons de valence. etc. Complétez vos notes en conséquence, en notant les éléments qui se trouvent sous chaque colonne.
Notez sur la carte finale que les éléments de la colonne 8 sont uniques. Ces éléments, les éléments du groupe 8, sont également appelés gaz nobles. Ils ont tous une coquille d'électrons de valence complète et ne sont donc pas aussi importants que les groupes 1 à 7. Conservez vos cartes de correspondance dans l'ordre numérique et faites-y souvent référence - le nombre d'électrons de valence pour chaque élément d'une carte donnée est égal au numéro de groupe. aussi sur cette carte.