Contenu
Les isotopes sont des atomes d'un même élément ayant un nombre différent de neutrons dans leurs noyaux; lorsqu'elles sont introduites dans le corps humain, elles peuvent être détectées par rayonnement ou par un autre moyen. Les isotopes, utilisés avec des équipements sophistiqués, offrent aux professionnels de la santé une «fenêtre» puissante sur le corps, leur permettant de diagnostiquer les maladies, d’étudier les processus biologiques et d’enquêter sur les mouvements et le métabolisme des médicaments chez les personnes vivantes.
Isotopes Stables et Instables
Les isotopes peuvent être stables ou instables. les instables émettent des radiations, pas les stables. Par exemple, l'atome de carbone 12 stable représente 98,9% de tout le carbone sur Terre; Comme l'isotope le plus rare, le carbone 14, est radioactif et qu'il change avec le temps, les scientifiques l'utilisent pour déterminer l'âge de spécimens et de matériaux biologiques parfois anciens. Chimiquement, les isotopes stables et instables agissent à peu près de la même manière, permettant aux médecins de remplacer les atomes stables par des atomes radioactifs dans les médicaments utilisés pour retracer les activités biologiques. Les isotopes stables, facilement identifiables à l'aide d'un appareil appelé spectromètre de masse, aident les chercheurs à déterminer les conditions dans le sang et les tissus lorsque la radioactivité n'est pas souhaitable.
Recherche en nutrition
Les isotopes stables aident les scientifiques en nutrition à surveiller le mouvement des minéraux dans l'organisme. Par exemple, parmi les quatre isotopes stables du fer, le fer 56 représente naturellement environ 92%, le plus rare étant le fer 58 à 0,3%. Un scientifique donne à un sujet-test des doses de fer 58 et surveille les quantités de différents isotopes de fer dans le sang et d'autres échantillons biologiques. Comme le fer 58 est plus lourd que le fer 56, un spectromètre de masse les distingue facilement. Les premiers échantillons montreront davantage de fer 56, mais au fil du temps, on trouvera du fer 58 en quantités importantes dans divers tissus et substances, ce qui permettra au scientifique de mesurer avec précision la façon dont le corps traite le fer.
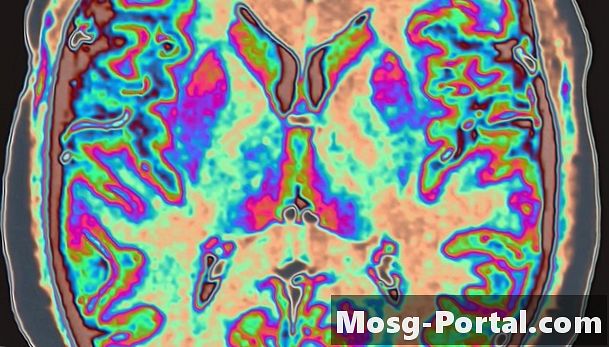
PET Scans
La tomographie par émission de positrons produit des images tridimensionnelles d'organes et de tissus grâce à l'utilisation d'isotopes radioactifs. Les isotopes, tels que le fluor 18, émettent des rayons gamma - une forme d’énergie qui traverse le corps et passe dans un détecteur. Lorsqu'il est combiné avec du sucre et administré à un patient, le fluor migre vers les tissus qui métabolisent activement le sucre, tels que les zones du cerveau d'une personne travaillant sur des problèmes de mathématiques. Les scanners PET montrent ces parties du corps en détail. En observant les différents niveaux de métabolisme, un médecin peut identifier les signes anormaux d'anomalies tels que tumeurs et démence.
MPI Scans
Une analyse d'imagerie de perfusion du myocarde utilise des isotopes radioactifs pour produire des images selon une méthode similaire à une analyse par PET, mais permettant de surveiller le cœur en temps réel. Selon le Stanford University Hospital, cette technique utilise des isotopes tels que le technétium 99 ou le thallium 201. Ces isotopes sont injectés dans une veine et se dirigent vers le cœur. Une caméra spécialisée capte les rayons gamma émis et produit une image du cœur qui bat dans des conditions de repos et de stress, permettant ainsi à un médecin d’évaluer la santé de l’organe.