Contenu
Les enzymes sont des molécules de protéines critiques dans les systèmes vivants qui, une fois synthétisées, ne sont généralement pas transformées en molécules d'un autre type, tout comme les substances absorbées comme carburant pour les processus digestifs et respiratoires (sucres, graisses, oxygène moléculaire, par exemple). C’est parce que les enzymes sont catalyseursCela signifie qu’ils peuvent participer à des réactions chimiques sans être modifiés par eux-mêmes, un peu comme le modérateur d’un débat public qui, idéalement, amène les participants et le public vers une conclusion en dictant les termes de l’argument sans ajouter d’informations uniques.
Plus de 2 000 enzymes ont été identifiées et chacune d'entre elles est impliquée dans une réaction chimique spécifique. Les enzymes sont donc spécifiques au substrat. Ils sont regroupés dans une demi-douzaine de classes en fonction du type de réactions auxquelles ils participent.
Bases de l'enzyme
Les enzymes permettent à un grand nombre de réactions de se produire dans des conditions de homéostasieou équilibre biochimique global. Par exemple, de nombreuses enzymes fonctionnent mieux à un pH (acidité) proche du pH que l'organisme maintient normalement, ce qui est dans la gamme de 7 (c'est-à-dire, ni alcalin ni acide). D'autres enzymes fonctionnent mieux à pH bas (acidité élevée) en raison des exigences de leur environnement; Par exemple, l'intérieur de l'estomac, où certaines enzymes digestives sont actives, est très acide.
Les enzymes participent à des processus allant de la coagulation sanguine à la synthèse de l'ADN, en passant par la digestion. Certains se trouvent uniquement dans les cellules et participent à des processus impliquant de petites molécules, telles que la glycolyse; d'autres sont sécrétées directement dans les intestins et agissent sur des matières en vrac telles que des aliments avalés.
Comme les enzymes sont des protéines ayant des masses moléculaires relativement élevées, elles ont chacune une forme tridimensionnelle distincte. Cela détermine les molécules spécifiques sur lesquelles ils agissent. En plus d'être dépendant du pH, la forme de la plupart des enzymes dépend de la température, ce qui signifie qu'elles fonctionnent le mieux dans une plage de température assez étroite.
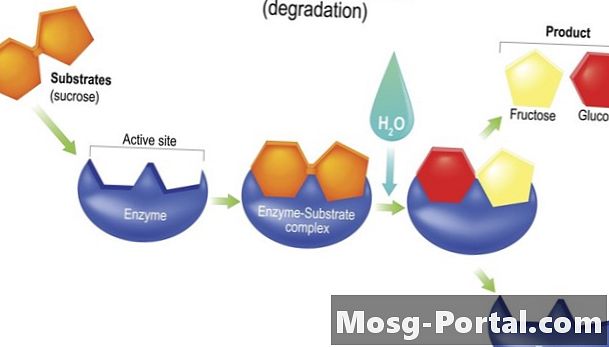
Comment fonctionnent les enzymes
La plupart des enzymes agissent en abaissant le énergie d'activation d'une réaction chimique. Parfois, leur forme rapproche physiquement les réactifs dans le style, peut-être, d’un entraîneur d’équipe sportive ou d’un responsable de groupe de travail soucieux d’accomplir sa tâche plus rapidement. On pense que lorsque les enzymes se lient à un réactif, leur forme change de manière à déstabiliser le réactif et à le rendre plus sensible aux modifications chimiques de la réaction.
Les réactions pouvant se dérouler sans apport d'énergie sont appelées réactions exothermiques. Dans ces réactions, les produits ou le ou les produits chimiques formés au cours de la réaction ont un niveau d'énergie inférieur à celui des produits chimiques qui servent d'ingrédients de la réaction. De cette façon, les molécules, comme l'eau, "cherchent" leur propre niveau (d'énergie); les atomes "préfèrent" être dans des arrangements avec une énergie totale inférieure, tout comme l'eau coule en descente jusqu'au point physique disponible le plus bas. En mettant tout cela ensemble, il est clair que les réactions exothermiques se déroulent toujours naturellement.
Cependant, le fait qu'une réaction se produise même sans apport ne dit rien sur la vitesse à laquelle cela se produira. Si une substance absorbée dans le corps se transforme naturellement en deux substances dérivées pouvant servir de sources directes d'énergie cellulaire, cela ne sert à rien si la réaction prend naturellement plusieurs heures, voire plusieurs jours. En outre, même lorsque l’énergie totale des produits est supérieure à celle des réactifs, le trajet énergétique n’est pas une pente douce sur un graphique; au lieu de cela, les produits doivent atteindre un niveau d'énergie supérieur à celui avec lequel ils ont commencé pour pouvoir "surmonter la bosse" et la réaction peut se poursuivre. Cet investissement initial en énergie dans les réactifs qui rapporte sous forme de produits est le énergie d'activationou Eune.
Types d'enzymes
Le corps humain comprend six grands groupes ou classes d’enzymes.
Oxydoréductases augmenter la vitesse des réactions d'oxydation et de réduction. Dans ces réactions, également appelées réactions d'oxydoréduction, l'un des réactifs abandonne une paire d'électrons qu'un autre réactif gagne. Le donneur à paire d'électrons est dit oxydé et agit en tant qu'agent réducteur, tandis que le récepteur à paire d'électrons est réduit est appelé agent oxydant. Une façon plus simple de formuler cela est que dans ce type de réactions, des atomes d'oxygène, des atomes d'hydrogène ou les deux sont déplacés. Les exemples incluent la cytochrome oxydase et la lactate déshydrogénase.
Transferases la vitesse le long du transfert de groupes d'atomes, tels que méthyle (CH3), acétyle (CH3CO) ou amino (NH2), d’une molécule à une autre. L'acétate kinase et l'alanine désaminase sont des exemples de transférases.
Hydrolases accélérer les réactions d'hydrolyse. Les réactions d'hydrolyse utilisent de l'eau (H2O) scinder une liaison dans une molécule pour créer deux produits filles, généralement en fixant le groupe -OH (groupe hydroxyle) de l’eau à l’un des produits et un seul -H (atome d’hydrogène) à l’autre. Entre-temps, une nouvelle molécule est formée à partir des atomes déplacés par les composants -H et -OH. Les enzymes digestives lipase et sucrase sont des hydrolases.
Lyases augmenter la vitesse d'addition d'un groupe moléculaire à une double liaison ou d'éliminer deux groupes d'atomes voisins pour créer une double liaison. Celles-ci agissent comme des hydrolases, sauf que le composant éliminé n'est pas déplacé par de l'eau ou des portions d'eau. Cette classe d'enzymes comprend l'oxalate décarboxylase et l'isocitrate lyase.
Les isomérases accélérer les réactions d'isomérisation. Ce sont des réactions dans lesquelles tous les atomes originaux du réactif sont retenus mais sont réarrangés pour former un isomère du réactif. (Les isomères sont des molécules avec la même formule chimique, mais des agencements différents.) Les exemples incluent la glucose-phosphate isomérase et l'alanine racémase.
Ligases (également appelées synthétases) augmentent la vitesse de jonction de deux molécules. Ils y parviennent généralement en utilisant l’énergie issue de la décomposition de l’adénosine triphosphate (ATP). Des exemples de ligases comprennent l'acétyl-CoA synthétase et l'ADN ligase.
Inhibition d'enzymes
Outre les changements de température et de pH, d'autres facteurs peuvent entraîner une diminution ou une fermeture de l'activité des enzymes. Dans un processus appelé interaction allostérique, la forme de l'enzyme est temporairement modifiée lorsqu'une molécule se lie à une partie de celle-ci, loin de l'endroit où elle rejoint le réactif. Cela conduit à une perte de fonction. Parfois, cela est utile lorsque le produit lui-même sert d’inhibiteur allostérique, car c’est généralement le signe que la réaction est survenue au point où le produit additionnel n’est plus nécessaire.
En inhibition compétitive, une substance appelée composé régulateur entre en compétition avec le réactif pour le site de liaison. Cela revient à essayer de mettre plusieurs clés de travail dans la même serrure en même temps. Si suffisamment de ces composés régulateurs se lient à une quantité suffisante de l'enzyme présente, cela ralentit ou arrête le processus réactionnel. Cela peut être utile en pharmacologie, car les microbiologistes peuvent concevoir des composés qui rivalisent avec les sites de liaison des enzymes bactériennes, ce qui rend beaucoup plus difficile pour la bactérie de provoquer une maladie ou de survivre dans le corps humain, période.
Dans l'inhibition non compétitive, une molécule inhibitrice se lie à l'enzyme à un endroit différent du site actif, similaire à ce qui se passe lors d'une interaction allostérique. L'inhibition irréversible se produit lorsque l'inhibiteur se lie de manière permanente à l'enzyme ou la dégrade de manière significative, de sorte que sa fonction ne peut pas récupérer. Les gaz neurotoxiques et la pénicilline ont tous deux recours à ce type d'inhibition, bien que leurs intentions soient radicalement différentes.