Contenu
- Valence
- La règle de l'octet
- Des liaisons covalentes
- Liaisons d'hydrogène
- Covalent v. Liaisons d'hydrogène
Les liaisons covalentes et les liaisons hydrogène sont des forces intermoléculaires primaires. Des liaisons covalentes peuvent se produire entre la plupart des éléments du tableau périodique. Les liaisons hydrogène sont une liaison spéciale entre un atome d'hydrogène et un atome d'oxygène, d'azote ou de fluor.
Valence
••• Jupiterimages / Photos.com / Getty ImagesLa puissance d'un élément à combiner avec d'autres éléments est représentée par un numéro attribué appelé la valence. Pour les ions, la valence est égale à la charge électrique. Par exemple, la valence pour le chlore est 3p5, il gagnera donc facilement un électron et l’ion résultant est Cl-.
La règle de l'octet


La règle de l'octet est basée sur l'idée que la configuration des gaz rares (s2p6) est la plus favorable et peut être obtenue avec la formation de liaisons paire d'électrons avec d'autres atomes.
Des liaisons covalentes
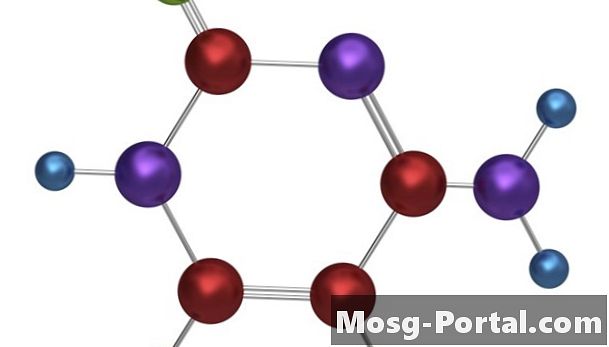
••• Tempusfugit / iStock / Getty ImagesDes liaisons covalentes se forment lorsque deux atomes ou plus se partagent des électrons pour remplir leurs couches d'électrons les plus externes.
Liaisons d'hydrogène


Une liaison hydrogène se produit lorsque la charge partiellement positive d'un atome d'hydrogène se lie à une molécule électronégative, généralement de l'oxygène, de l'azote ou du fluor.
Covalent v. Liaisons d'hydrogène

Les liaisons covalentes et hydrogènes sont des formes de forces intermoléculaires. Les liaisons covalentes peuvent apparaître avec la plupart des éléments du tableau périodique, tandis que les liaisons hydrogène se situent généralement entre un atome d'hydrogène et une molécule d'oxygène, d'azote ou de fluor. De plus, les liaisons hydrogène n’ont qu’environ 1/10 de la force d’une liaison covalente.